来源:清新电源
01 研究背景
电催化CO2还原反应是实现碳中和及碳循环的重要途径之一。在CO2还原反应(CO2RR)中,随着电子和质子转移数的增加,反应路径变得越来越复杂。而CO2还原为CH4的电催化过程涉及8电子转移。因此,探索该催化机理对于理解CO2RR具有重要意义。过渡金属Cu是实现电催化CO2转化为多电子还原产物的最有效的单金属催化剂。要实现该过程,需要解决两个关键问题:一是抑制碳-碳偶联反应,避免CO等副产物的形成;二是加速8电子转移的缓慢动力学过程,从而促进CH4生成。构建Cu单原子催化剂可以有效抑制C-C偶联反应。然而,反应过程中生成的*CO中间体及其随后的质子化过程会导致各种单碳产物生成,降低了产物的选择性。
最近的理论研究和实验结果表明,改变CO2的活化位点,即生成与O原子优先成键的中间体(*OCHO),能有效阻断CO的反应路径,促进CH4的生成。这就需要引入基底材料,利用金属位点与基底之间的电子相互作用,调控金属原子的电子结构,从而影响关键中间体的吸附行为。
石墨炔(GDY)由sp2-和sp-杂化的碳原子组成,其独特的-C≡C-C≡C-结构可以有效地稳定单原子,并促进GDY与金属原子中心之间的电荷转移。因此,它可以引起单原子的电子环境变化。此外,理论计算表明,得益于其多孔结构,GDY具有良好的CO2吸附能力,这是后续进行还原反应的前提条件。这些特点使GDY成为一种合适的基底,可用于合成和调控单原子催化剂。
02 成果简介
天津理工大学王梅教授、BETVLCTOR伟德在线登录平台袁明鉴研究员、河南工业大学Guodong Shi博士(共同通讯作者)等通过石墨炔锚定Cu单原子得到Cu SAs/GDY复合催化剂,用于电催化CO2还原为CH4。通过在Cu SAs/GDY中构建Cu-C键,可以调控中间体,引导更容易生成CH4的反应路径,从而显著提高其催化性能。实验结果表明,Cu SAs/GDY作为一种新型的电催化剂,催化CO2还原生成CH4具有较高的法拉第效率(81%)和优良的稳定性。该工作以“Constructing Cu-C Bond in Graphdiyne-Regulated Cu Single Atom Electrocatalyst for CO2 Reduction to CH4”为题发表在Angewandte Chemie International Edition上。
03 研究亮点
(1)通过将Cu SAs原位锚定在石墨炔基底上,成功构建了Cu-C键。
(2)Cu-C键能够调控Cu单原子的电子环境,稳定Cu单原子。此外,它还可以控制形成的反应中间体为*OCHO,促进了CH4的生成。
04 图文导读
图1 Cu SAs/GDY模型的DFT计算结果。
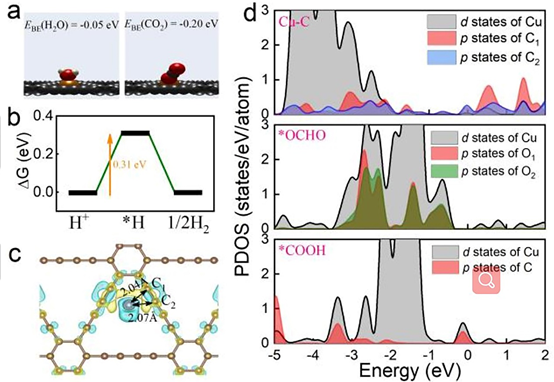
(a) CO2和H2O在Cu SAs/GDY上的结合能。插图分别为吸附CO2和H2O的原子模型。
(b) HER的吉布斯自由能变化图。
(c) Cu原子与GDY成键前后的电荷密度差。
(d) Cu SAs/GDY界面的Cu-C、中间产物*OCHO、*COOH的投影态密度。
电催化过程中,CO2RR的竞争反应是析氢反应(HER),这明显降低了CO2RR的法拉第效率。如图1a所示,计算得到催化剂与CO2的结合能为-0.20 eV,而与H2O的结合能为-0.05 eV,这说明该催化剂对CO2分子的亲和力比H2O分子强。对CO2分子的强亲和力促进了CO2在催化剂表面的富集,从而使CO2优先占据Cu活性位点,抑制HER的Volmer-Heyrovsky步骤。此外,HER的Vomer-Tafel步骤主要受到H与催化剂的结合能影响。如图1b所示,计算得到H结合能为0.31 eV,该值远大于铂、铅等贵金属表面的结合能。因此,HER在Cu SAs/GDY上较难发生。如图1c所示,Cu原子向GDY的电荷转移显著,这是由于-C≡C-C≡C-结构具有较强的吸电子特性。这种电子相互作用使Cu原子具有空的d轨道电子,有利于吸附态CO2的p轨道电子并与之耦合。
为了深入了解这种化学相互作用,作者计算了界面的投影态密度(PDOS)。如图1d所示,Cu的d轨道与C链的p轨道有很大的重叠,这表明Cu与C链之间存在较强的轨道杂化。上述结果有力地证实了Cu SAs/GDY催化剂中Cu-C键的形成。作者认为Cu-C键的存在使得Cu原子的电子结构发生了适当的改变,从而可以有效地调整一些关键中间产物的吸附行为。因此,作者也计算了可能的中间体*OCHO和*COOH,并在随后的机理部分进行了详细分析。
图2
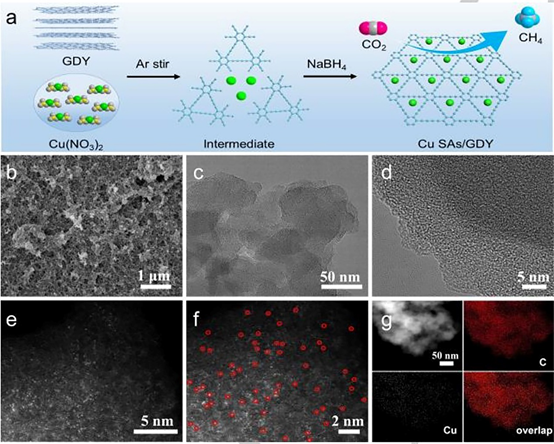
(a) Cu SAs/GDY合成示意图。
(b) Cu SAs/GDY的SEM图。
(c) Cu SAs/GDY的TEM图。
(d) Cu SAs/GDY的HRTEM图。
(e, f) 像差校正后的Cu SAs/GDY HAADF-STEM图。铜单原子用红色圆圈标记。
(g) 对应的元素分布图。
如图2a所示,为催化剂的合成过程,采用原位吸附还原法,得到该催化剂。SEM和TEM图说明,Cu SAs/GDY样品中未发现金属纳米粒子或团簇(图2b-d)。图2e和f所示的像差校正的HAADF-STEM说明Cu单原子均匀分布在整个GDY框架上。此外,图2g的元素分布图进一步证实了Cu和C元素在催化剂上均匀分布。
图3
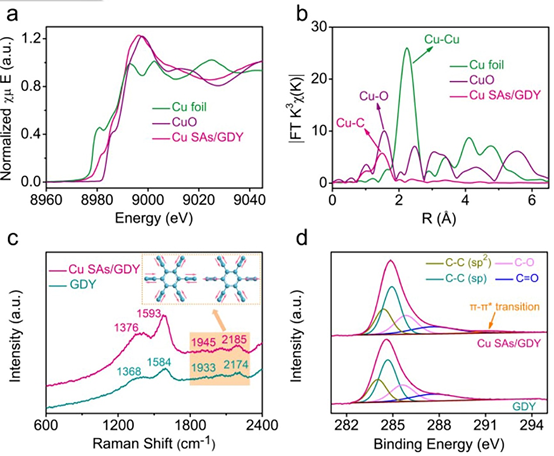
(a) Cu SAs/GDY、CuO和Cu箔在Cu k边的XANES光谱。
(b) R空间的傅里叶变换。
(c) 原始GDY和Cu SAs/GDY的Raman光谱。
(d) 原始GDY和Cu SAs/GDY的XPS图。
如图3a所示,Cu SAs/GDY的吸收边位置位于标准铜箔与CuO的吸收边之间,说明Cu SAs/GDY中Cu原子的价态高于金属Cu0。Cu SAs/GDY和Cu箔的傅里叶变换(FT) EXAFS光谱如图3b所示。在Cu SAs/GDY结构中,只观察到一个位于1.48 Å的主峰,归属于Cu-C键。此外,没有观察到Cu-Cu键,说明该催化剂中的Cu元素主要以孤立的单原子形式存在。拉曼光谱如图3c所示,原始GDY的四个峰分别对应于共轭二炔键的D带、G带和振动带。而Cu SAs/GDY的共轭二炔烃单元的峰相对于原始GDY的峰正移,这再次证实了Cu单原子锚定在GDY上,形成了Cu-C键。这一结果与图2d中C 1s XPS的结果非常吻合。Cu SAs/GDY样品在291.1 eV处出现了π-π*跃迁峰,揭示了Cu原子与GDY之间的电荷相互作用。这种密切的相互作用将对Cu单原子的电子态产生显著影响,导致Cu单原子的价态高于Cu0。
图4 催化性能评价。
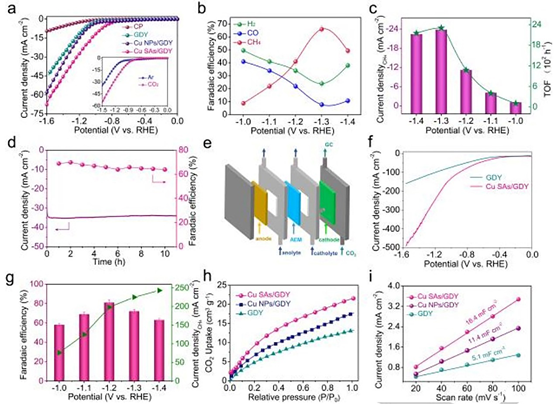
(a)制备的催化剂在CO2饱和的0.1 M KHCO3溶液中的LSV曲线。插图:在Ar饱和与CO2饱和的0.1 M KHCO3溶液中,Cu SAs/GDY的LSV比较。
(b) Cu SAs/GDY在不同电位下的法拉第效率。
(c) CH4偏电流密度和Cu SAs/GDY的TOF值。
(d) Cu SAs/GDY在-1.3 V时的稳定性测试。
(e) 流动槽装置示意图。
(f) 1.0 M KOH电解液中,GDY和Cu SAs/GDY的LSV曲线。
(g) 生成CH4的法拉第效率和Cu SAs/GDY催化CH4生成的偏电流密度。
(h) 催化剂对CO2的等温吸附线。
(i) 由样品的双层电容估算出的电化学活性表面积。
在CO2饱和的0.1 M KHCO3水溶液中,使用三电极体系,在H型电解槽中进行催化性能测试。如图4a所示,Cu SAs/GDY具有较高的几何电流密度,表明该体系发生了CO2还原反应,且其CO2RR活性最高。在-1.2 V的电位下,Cu SAs/GDY的电流密度为-40 mA cm-2,分别是Cu NPs/GDY和原始GDY的2.2和2.8倍。从图4b中可以清楚地看出,随着电解电位的增加,CH4的法拉第效率先升高后降低。在-1.3 V时FE值达到最大值66%,大约是Cu NPs/GDY的3倍。如图4c所示,Cu SAs/GDY的最大CH4偏电流密度(-24 mA cm-2)远高于Cu NPs/GDY。此外,在-1.3 V电压下,Cu SAs/GDY催化CH4生成的TOF为2311 h-1,表明该催化剂具有良好的产CH4活性。作者还进行了长时间的恒电位测试来评价Cu SAs/GDY的稳定性。催化剂的电流密度下降很小,而在10小时的CO2电还原测试中,生成CH4的FE保持稳定(图4d)。作者还利用自制的三电极流动式电解槽评估了Cu SAs/GDY的CO2RR活性(图4e)。从LSV极化曲线可以看出,Cu SAs/GDY在-1.4 V时的总电流密度为-386 mA cm-2,优于GDY (-130 mA cm-2),表明其对CO2还原具有较高的活性(图4f)。如图4g所示,Cu SAs/GDY显示CH4 的FE最大值为81%,其较高的CH4偏电流密度为-243 mA cm-2。Cu SAs/GDY对CO2的吸附性能最好,在室温、1 atm下的最大吸附量为38 cm-3 g-1,分别是Cu NPs/GDY和原始GDY的1.8和2.6倍。Cu SAs/GDY对CO2较好的吸附能力可以进一步提高其电催化CO2还原活性。由图4i可知,Cu SAs/GDY的活性位点相比于原始GDY、Cu NPs/GDY显著增加,有利于提高CO2还原效率。
图5在Cu SAs/GDY上进行CO2RR 生成CH4的DFT计算。
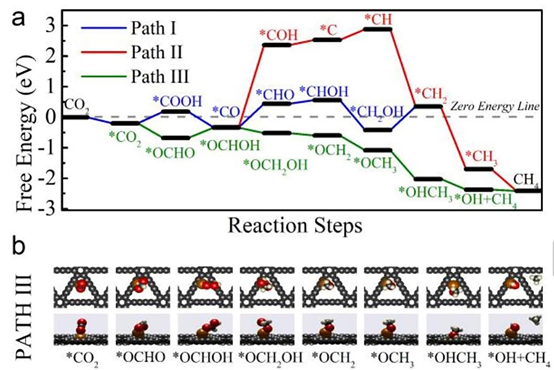
(a) 可能的反应路径和相应的零电势自由能图。
(b) Path III所涉及的吸附物种的最优原子模型。
如图5a所示为三种可能的CH4生成途径。相比于Path I、II,在Path III中,*OCHOH中间体之后的步骤是放热的,说明通过Path III生成CH4是顺利而高效的。在图5b所示的优化几何构型中,可以明显看出*OCHO是CGDY-Cu-O*的中间体,*COOH是CGDY-Cu-C*的中间体。*OCHO的自由能比*COOH低约0.88 eV,说明在Cu SAs/GDY催化体系中,*OCHO比*COOH更稳定。图1d的PDOS图说明,O原子的p轨道与Cu的d轨道重叠共振较大,表明在*OCHO中,O和Cu之间存在较强的轨道杂化。因此在Cu SAs/GDY上生成的*OCHO中间体比*COOH更有利于生成CH4。
05 总结与展望
本文采用石墨炔锚定Cu单原子,作为CO2RR电催化剂,实现了CO2向CH4的高效还原转化。Cu SAs/GDY的优异催化性能主要来自以下几个因素: (1)得益于GDY中独特的乙炔键结构,Cu SAs可以被有效地锚定,保证了催化活性位点的高效暴露,避免了多碳产物的形成。Cu-C化学键的形成有效调控了Cu原子的电子结构,促进了*OCHO中间体的形成。最后,Cu SAs/GDY有较强的CO2吸附能力,极大地抑制了HER。这项工作为在原子水平上提高CO2RR的选择性提供了新的见解。
06 文献链接
Constructing Cu-C Bond in Graphdiyne-Regulated Cu Single Atom Electrocatalyst for CO2 Reduction to CH4. (Angew. Chem. Int. Ed. 2022, DOI: 10.1002/anie.202203569)
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202203569


