来源:BODIPY Fluorophores

1. 研究背景
心血管疾病(CVD)一直是全球死亡的主要原因,每年约占全球死亡人数的三分之一,动脉粥样硬化(AS)是引起CVD的主要原因。泡沫细胞通常来源于脂质负载的巨噬细胞,不仅是动脉粥样硬化斑块的主要成分,也是AS的关键驱动因素。随着AS的发展,斑块中的泡沫细胞发生凋亡,积累和沉淀并形成坏死性脂质核心。因此,斑块纤维变得薄而脆弱,导致脆弱斑块的形成,这是血栓的主要原因,血栓会导致致命事件,如心肌梗死、中风,甚至猝死。因此,在早期准确检测AS并动态监测动脉硬化病变的发展至关重要。
细胞外小泡(EVs)存在于各种生物流体中,被认为是治疗各种疾病的有前景的液体活检生物标志物。EVs中特定蛋白质或miRNA的表达水平与疾病进展密切相关。对于AS,一组外泌体miRNA(如miRNA21、miRNA155、miRNA320b)已被认为是识别动脉粥样硬化过程和区分其不同表现的潜在循环生物标志物。然而,这些生物标志物极难检测,是因为它们在EVs中的含量极低且表达异质性巨大。
2. 结果与讨论
开发了一种体内荧光标记策略,可以对泡沫细胞衍生的EVs进行特异性染色,这些被标记的EVs从动脉粥样硬化斑块分泌到血液中,作为体外检测AS的生物标志物。设计了一种泡沫细胞靶向纳米荧光探针BI-PEG-PSBP NPs,该探针可以被细胞内的HClO特异性降解,以产生含三氟甲基的氟硼二吡咯荧光团(B-CF3),比率荧光信号FI540/FI740增强。由于该荧光团是亲脂性的,可以在脂滴(LDs)中富集。并通过疏水相互作用将负载LDs的B-CF3染料转移到泡沫细胞膜中,紧接着,分泌到外泌体膜中,这些循环的B-CF3携带的EVs可以直接在荧光光谱仪或微孔板读取器上检测,而无需求助于任何复杂的分析方法。
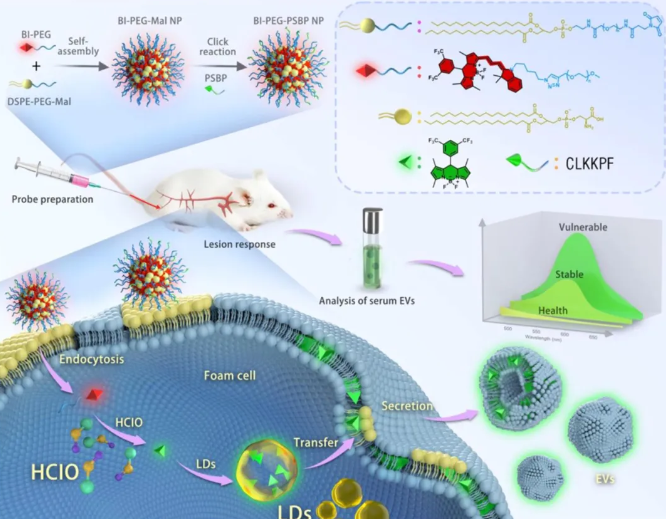
图1. BI–PEG-PSBP NPs的制备及其在动脉粥样硬化模型小鼠泡沫细胞中的代谢过程
DOI:10.1021/jacs.4c01173


