来源:高分子科技
病毒是由蛋白质和核酸组成的纳米级实体,其表面上的糖蛋白赋予了在侵入宿主细胞方面的出色能力。在病毒渗透过程中,病毒表面糖蛋白与活细胞膜上受体结合,促进病毒的内吞作用。随后病毒在早期内体或溶酶体中发生糖基单元水解导致蛋白质构象转变,从而引发膜融合过程,最终释放病毒基因进入细胞质。最近各种病毒仿生递送载体的构建,在一定程度上加快了药物递送领域的发展,但这些递送系统往往侧重模仿病毒单一特征。通过全链条模拟病毒感染过程,被认为是进一步提高药物递送效率的理想手段,但目前仍鲜有报道。
针对这一难题,BETVlCTOR登录网站余志林课题组在《德国应用化学》上以‘Assembly of Glycopeptides in Living Cells Resembling Viral Infection for Cargo Delivery’为题(DOI: 10.1002/anie.202404703R2),提出了一种糖肽级联靶向-水解-转化(THT)组装策略,通过引入半乳糖基化的丝氨酸,设计合成了含化疗药物伊利替康(IRI)和配体TSFAEYWNLLSP(PMI)的糖基化组装体SgVEIP,在活细胞内实现病毒感染全链条模拟的高效原位组装,提高药物递送效率。该研究展现了模拟病毒感染的糖肽原位级联THT组装在未来药物递送和癌症治疗方面的巨大潜力。
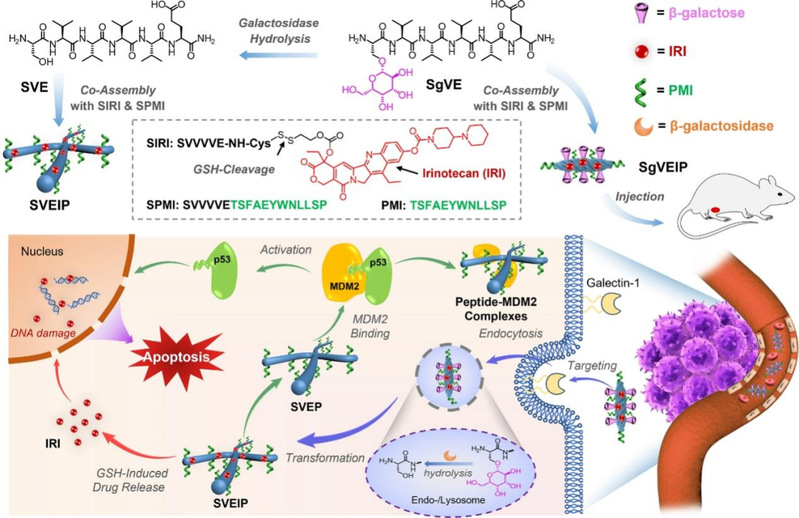
图1. 活细胞内类病毒感染糖肽级联靶向-水解-转化(THT)组装策略设计思路以实现有效的载体递送和癌症治疗的作用示意图。图片来源:Angew. Chem. Int. Ed.
近年来,多肽原位组装在克服递送障碍、延长细胞滞留以及精确执行治疗目标等方面展现了巨大潜力。因此,为进一步提高药物靶向的输送效率,在活细胞中开发出高效原位组装多肽生物诊疗剂显得尤为重要。该工作受糖蛋白在病毒感染过程起关键作用的启发,通过共同组装糖肽SgVE与SIRI和SPMI形成纳米结构SgVEIP,该糖基化组装体在半乳糖-Gal-1结合的靶向的作用下,可以靶向肿瘤细胞并在溶酶体被b-半乳糖苷酶水解,诱导原位组装形成组装体SVEIP。在由GSH引起的IRI释放后,保持的纳米纤维SVEP会破坏MDM2-p53的结合,从而释放p53,与IRI共同促进细胞死亡。
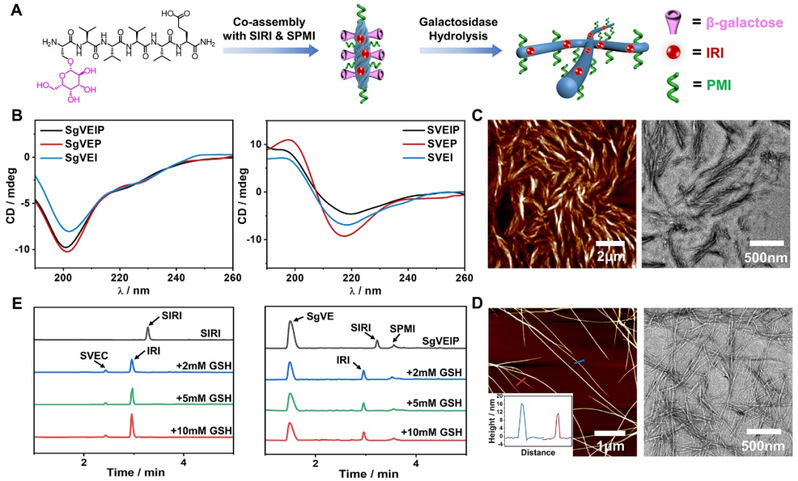
图2. SgVE或SVE与配体SIRI、SPMI共同组装的光谱、显微特征以及药物释放分析
此外,活体实验结果揭示了糖肽原位级联THT组装在肿瘤富集与滞留方面的优势,表明糖基化共组装体SgVEIP能够在肿瘤原位组装,有效地抑制肿瘤生长,并证实了多肽组装体优异的生物安全性及低细胞毒性。该工作凸显了模拟病毒感染的原位组装策略为未来的药物递送和癌症治疗提供了一条新途径。
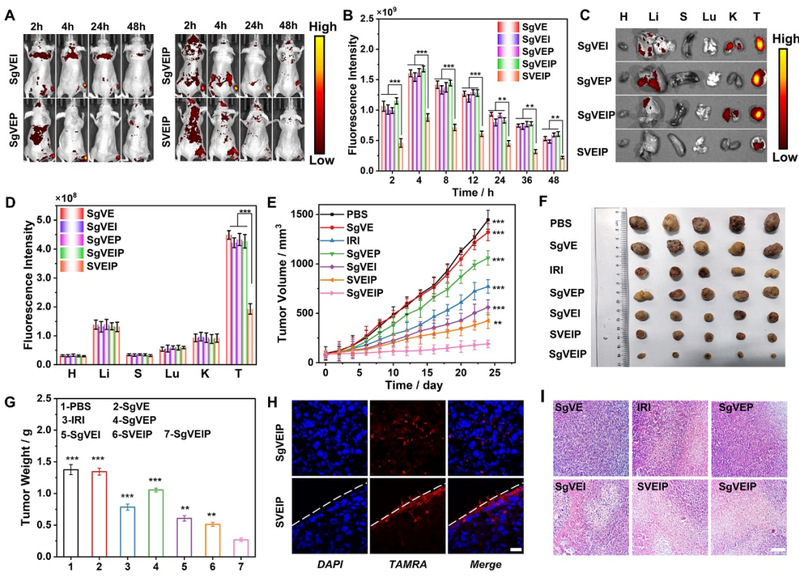
图3. 糖肽组装体SgVEIP在肿瘤内发生原位组装用于活体成像及治疗
这一成果近期发表在Angew. Chem. Int. Ed.上,论文第一作者是BETVlCTOR登录网站高分子化学与物理专业博士研究生田丰,共同第一作者是BETVLCTOR伟德在线登录平台博士研究生郭若宸,通讯作者为BETVlCTOR登录网站余志林教授。
论文信息:
Assembly of Glycopeptides in Living Cells Resembling Viral Infection for Cargo Delivery
Feng Tian#, Ruo-Chen Guo#, Chunxia Wu, Xin Liu, Zeyu Zhang, Yamei Wang, Hao Wang, Gongyu Li and Zhilin Yu*
Angewandte Chemie International Edition
DOI: 10.1002/anie.202404703R2
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202404703R2


