来源:超分子光化学与自组装

文章摘要
基于人工大环的纳米超分子不仅可以调节组装形态,还可以增强磷光共振能量转移(PRET)。在此,通过将透明质酸修饰的溴苯基吡啶(HAPY)、葫芦[n]脲(CB[n], n = 7/8)和能量受体苯桥联的吩噻嗪衍生物组装成水溶性磷光超分子,实现了高效的PRET,并通过大环CB[n]和组装限制实现了近红外(NIR)磷光发射。与HAPY/CB[7]的弱磷光纳米纤维相比,HAPY/CB[8]的球形纳米粒子不仅具有长达1.27 ms寿命的强绿色磷光,还可以作为能量供体,限制吩噻嗪阳离子在二次组装中的分布,从而实现从磷光体到三重态受体的高效PRET,实现在750 nm处的磷光发射和440 nm的超大斯托克斯位移。最终,通过多尺度约束增强的PRET纳米组装体成功应用于癌细胞靶向成像,为制备近红外磷光材料提供了新的见解。
背景介绍
近年来,纯有机室温磷光(RTP)材料在防伪、信息加密、光电材料、传感、催化、和生物成像等方面有着广泛的应用,成为当前研究的热点。在实现高效RTP生成的众多策略中,基于大环化合物的多尺度超分子束缚无疑是激活或增强发光材料磷光行为的有效途径。到目前为止,大多数磷光材料的发射波长都在可见光区,由于能隙定律造成的非辐射跃迁的限制,在水介质中实现近红外磷光是一个很大的挑战。利用长寿命磷光发光团作为供体,合理选择有机染料作为能量受体,通过超分子级联捕获和大环限制级联组装来制备近红外磷光或延迟荧光材料已经付出了许多努力。虽然PRET实现的延迟近红外荧光已经被报道过,但通过多尺度超分子限制促进高效磷光能量转移而实现的长寿命近红外磷光很少被报道。
结果与讨论

Scheme 1 基于葫芦[n]脲的可调谐纳米超分子近红外磷光成像。
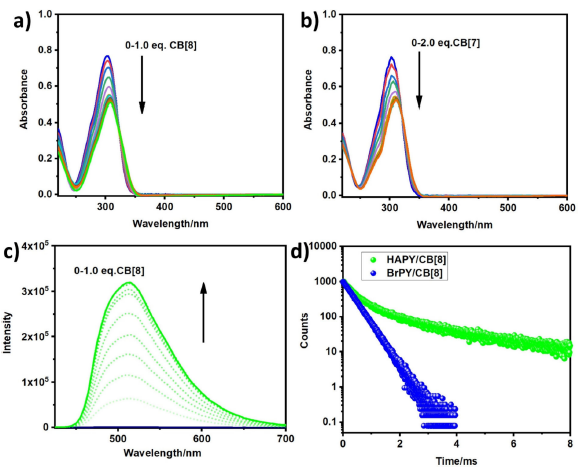
图1 光物理性质表征。
首先,合成了透明质酸修饰的溴苯基吡啶(HAPY)和模型化合物(BrPY),并通过溴化、偶联和季铵化反应合成两种四阳离子双吩噻嗪。选择BrPY作为模型化合物,研究了CB[n]与HAPY发光团之间的结合行为。随后,进行了发光团的UV-vis滴定实验,以探索CBs与BrPY的结合行为。从图1a可以看出,随着CB[8]浓度的增加,BrPY的吸收峰从305 nm红移到310 nm;同时吸收强度逐渐降低,这是由于CB[8]的包封造成的。通过紫外-可见光谱滴定实验测定了CB[7]与BrPY的结合常数(图1b),计算结果为2.30 × 106 M-1。因此,BrPY可以被CB[7]或CB[8]以不同的结合方式包裹,形成稳定的超分子复合物。通过光致发光实验,探讨了CBs约束对溴苯基吡啶衍生物发光行为的影响。从图1c可以看出,HAPY中没有出现明显的磷光信号,随着CB[8]的加入,510 nm处的发射信号逐渐增加;因此,长寿命的发射峰属于超分子的磷光信号。510 nm处发射峰的寿命为366.69 μs(图1d),不包括其短寿命荧光峰。与BrPY/CBs相比,在CB[8]和CB[7]的约束下,HAPY的磷光寿命更长(1.27 ms和51.49 μs),表明HAPY的多糖结构有利于高效磷光发射。

图2 PRET体系的构筑。
从以上结果可以看出,通过CB[n]限制,成功实现了可调的超分子磷光性能。作者进一步应用了磷光大环超分子和苯基桥联吩噻嗪衍生物(G1和G2)构建高效的PRET体系。如图2a、b所示,G1或G2存在时,HAPY/CB[8]的磷光强度逐渐降低,分别在750 nm和740 nm处出现新的发射信号。此外,HAPY/CB[8]的寿命从1.27 ms降低到162.22 μs和358.34 μs(图2c),初步表明HAPY/CB[8]的激发能转移到了吩噻嗪衍生物上。测定了HAPY/CB[8]/G1和HAPY/CB[8]/G2共聚体的近红外发射峰寿命分别为14.22 μs和6.65 μs(图2d)。图2e显示,组装体的荧光峰出现在680 nm处;因此,750 nm处的发射峰属于吩噻嗪的磷光信号。此外,在177 K时,超分子共聚体的光致发光光谱(图2e,f)在750 nm处有一个增强的发光峰。确认了750 nm的发光信号为磷光。根据得到的实验结果,可能的超分子能量传递机制(图2g)是HAPY在CB[8]的约束下产生高效的磷光发射。当它与吩噻嗪的阳离子络合形成异源二聚体后,能量从三重态体供体转移到单线态受体,然后在组装体中激子从单线态受体系间窜跃到三重态,从而产生长寿命的红色磷光。
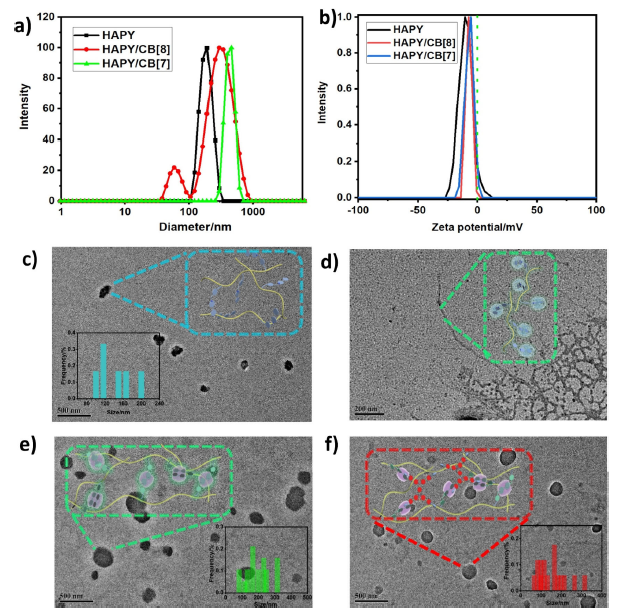
图 3 形貌表征。
通过动态光散射(DLS)、zeta电位(zeta potential)和透射电镜(TEM)等实验对组装体拓扑形态进行多尺度观察。如图3a所示,自聚集的HAPY的尺寸主要分布在200 nm左右。与CBs络合后,HAPY/CB[8]和HAPY/CB[7]的平均尺寸大于200 nm,这是由于HAPY/CB进一步组装形成了大的超分子。此外,zeta电位实验(图3b)显示,HAPY、HAPY/CB[7]和HAPY/CB[8]均为负值(-10.55、-7.46和-5.61 mV),表明这些组件的表面具有带负电荷的透明质酸单元。TEM图片显示,HAPY自组装形成直径为100~200nm的不规则纳米颗粒(图3c)。与HAPY/CB[7]形成的长纳米纤维相比(图3d),因为CB[8]可以结合两个阳离子主体,并在多糖中充当超分子交联剂,促进了纳米颗粒的紧密形成,HAPY/CB[8]形成了直径为83~317 nm的纳米颗粒(图3e)。图3f显示,HAPY/CB[8]/G1和HAPY/CB[8]/G2在溶液中保持纳米颗粒形态,平均尺寸约为309 nm和270 nm。证实了阳离子吩噻嗪衍生物与HAPY/CB[8]共组装。因此,CB[n]的多尺度约束和组装可以调节组装形态,形成具有不同磷光性能的纳米颗粒和纳米纤维。特别是,HAPY/CB[8]纳米颗粒可以作为磷光供体和限制受体,促进三重态磷光体向三重态受体的能量转移,实现高效的近红外磷光发射。
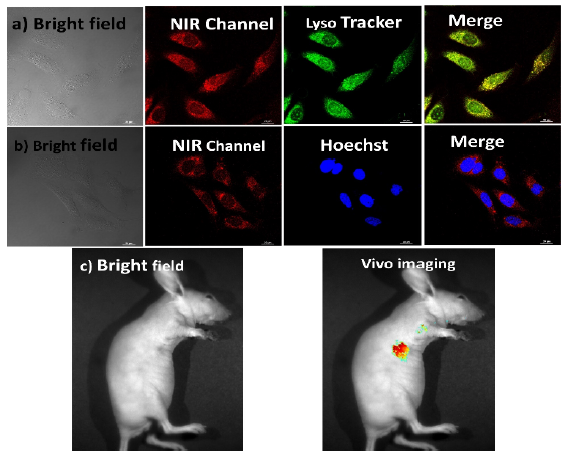
图4 细胞成像。
随后,由于PRET构建的纳米超分子具有良好的近红外磷光性能,并与带负电荷的透明质酸单元组装形成纳米颗粒,作者尝试将其作为靶想细胞成像的超分子近红外磷光探针。首先,用HAPY/CB[8]/G1培养HeLa细胞24 h,激光共聚焦显微镜观察。与发光微弱的293T细胞形成鲜明对比的是,HeLa细胞显示红色信号(图4a),这可能是由于纳米粒子的透明质酸单元可以被癌细胞的CD44受体识别,并促进它们进入癌细胞。作者进一步探索了近红外磷光探针在细胞器中的定位能力。经过近红外磷光组装体培养后,进一步用溶酶体探针(LysoTracker绿色)和细胞核染料(Hoechst)处理HeLa细胞。从图4a可以看出,LysoTracker的绿色荧光可以与HAPY/CB[8]/G1的红色荧光重叠,在合并后的图像中发出明亮的黄色信号,表明该溶酶体具有靶向标记能力。然而,从图4b的合并图来看,近红外探针无法定位在核内。因此,制备的近红外磷光超分子可以在癌细胞中靶向标记溶酶体。此外,还通过小鼠HeLa细胞模型评估了纳米探针在体内的成像能力。尾静脉注射(8 h)后,通过皮肤在肿瘤部位观察到红色信号(图4c),表明组装体在肿瘤部位积聚。因此,制备的近红外磷光纳米超分子具有针对溶酶体的靶向能力,可用于体内成像。
文章总结
综上所述,作者以透明质酸修饰的溴苯吡啶、葫芦脲和苯基桥接吩噻嗪衍生物为原料,通过CB[n]约束成功制备了形貌和磷光性能可调的纳米超分子。CB[7]具有较小的空腔,限制了HAPY形成弱磷光纳米纤维,与吩噻嗪衍生物共组装后不能实现PRET。与HAPY/CB[7]形成鲜明对比的是,被CB[8]交联的HAPY不仅发出了更亮的绿光,寿命延长到1.27 ms,而且可以组装成致密的纳米颗粒,这些纳米颗粒进一步与能量受体四阳离子吩噻嗪级联组装,在有效的多尺度约束下实现了三重态HAPY/CB[8]到三重态吩噻嗪衍生物的高效磷光共振能量转移。在水介质中表现出440 nm的超大Stokes位移,在750 nm处实现强红色磷光发射,QY高达4.46%。最后,水溶性近红外磷光超分子成功用于靶向癌细胞标记和活体小鼠成像,为功能性近红外磷光材料提供了一种便捷的方法。
文章信息
J. Yu, H. Yu, J. Niu, Z. Lei, Y. Liu, Nano Lett. DOI:10.1021/acs.nanolett.4c04920.


